L’immunité face au gluten: mécanismes moléculaires de la maladie coeliaque et physiopathologie
L’étude des mécanismes moléculaires de la maladie cœliaque permet de mieux comprendre comment, chez certaines personnes, le système immunitaire réagit de manière inappropriée à la présence de gluten et entraîne des lésions de la muqueuse intestinale.
Les mécanismes impliqués dans la maladie cœliaque sont complexes et font encore l’objet de nombreuses recherches. Plusieurs hypothèses ont été proposées au fil des années ; dans cet article, je vais en détailler une, qui repose sur des données aujourd’hui bien décrites.
Afin de faciliter la compréhension des différents acteurs du système immunitaire évoqués, vous pouvez, si besoin, à consulter l’article dédié au fonctionnement du système immunitaire chez l’Homme.
Les étapes des mécanismes moléculaires de la maladie coeliaque
Le gluten : point de départ des mécanismes moléculaires de la maladie coeliaque
Le point de départ des mécanismes moléculaires de la maladie cœliaque est la présence de gluten dans le tube digestif. Le gluten est un ensemble de protéines que l’on retrouve dans certaines céréales. Lors de la digestion, ces protéines ne sont pas entièrement dégradées et des fragments de gluten persistent dans la lumière intestinale.
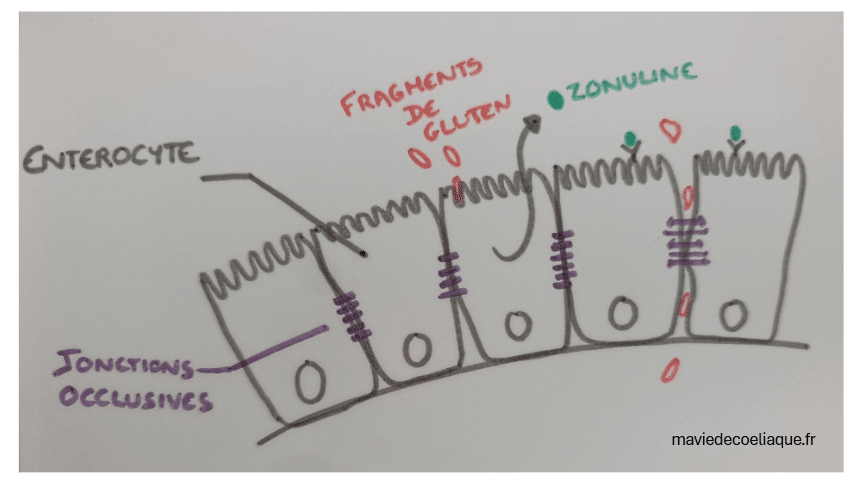
Ces fragments de gluten se retrouvent au contact de la muqueuse intestinale, au niveau des microvillosités des entérocytes, qui sont les cellules de l’épithélium intestinal. En situation normale, les entérocytes forment une couche de cellules très étroitement associées entre elles.
Les entérocytes sont reliés par des jonctions intercellulaires, qui assurent la cohésion de la muqueuse intestinale et participent à son rôle de barrière. Cette organisation permet de contrôler finement les échanges entre le contenu intestinal et l’organisme. Le passage des molécules s’effectue de manière sélective, principalement à travers les cellules elles-mêmes, grâce à des systèmes de transport spécifiques.
Dans la maladie cœliaque, la présence de fragments de gluten au contact de la muqueuse intestinale s’accompagne d’une modification de cette régulation. Il a notamment été décrit une augmentation de la libération de zonuline, une protéine impliquée dans la modulation des jonctions intercellulaires.
Cette modulation peut conduire à un passage anormal de certains fragments de gluten à travers la muqueuse intestinale. Il ne s’agit pas d’une disparition totale de la barrière intestinale, mais d’un fonctionnement inadapté dans un contexte particulier, qui constitue l’une des premières étapes des mécanismes moléculaires de la maladie cœliaque.
Alerte immunitaire locale dans la muqueuse intestinale
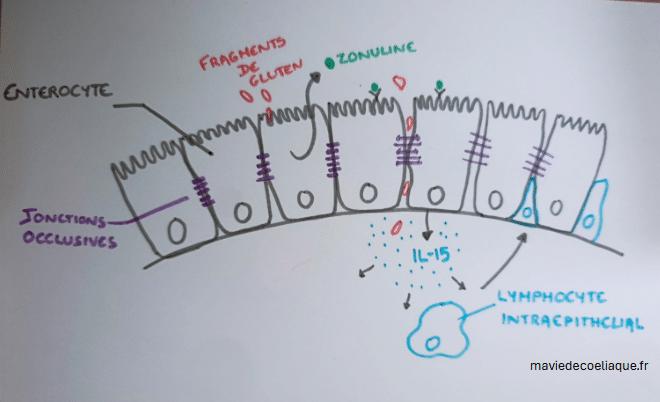
Le passage anormal de fragments de gluten à travers la muqueuse intestinale s’accompagne d’une réponse locale de l’épithélium intestinal. Les entérocytes exposés à ces fragments produisent alors certaines molécules de signalisation, dont l’interleukine 15 (IL-15).
L’IL-15 est une molécule impliquée dans l’activation du système immunitaire. Dans la muqueuse intestinale, sa production contribue à l’activation des lymphocytes intra-épithéliaux, qui sont des cellules immunitaires normalement présentes entre les entérocytes.
Ces lymphocytes intra-épithéliaux perçoivent cette situation comme un signal anormal au niveau de l’épithélium. Leur activation entraîne une altération progressive des entérocytes, participant aux premières lésions de la muqueuse intestinale.
Cette étape marque le début d’un processus inflammatoire local, qui s’installe dans la durée et prépare l’activation de mécanismes immunitaires plus spécifiques. Elle constitue ainsi une étape clé des mécanismes moléculaires de la maladie cœliaque, à l’interface entre la barrière intestinale et le système immunitaire.
Rôle de la transglutaminase tissulaire dans les mécanismes moléculaires de la maladie coeliaque
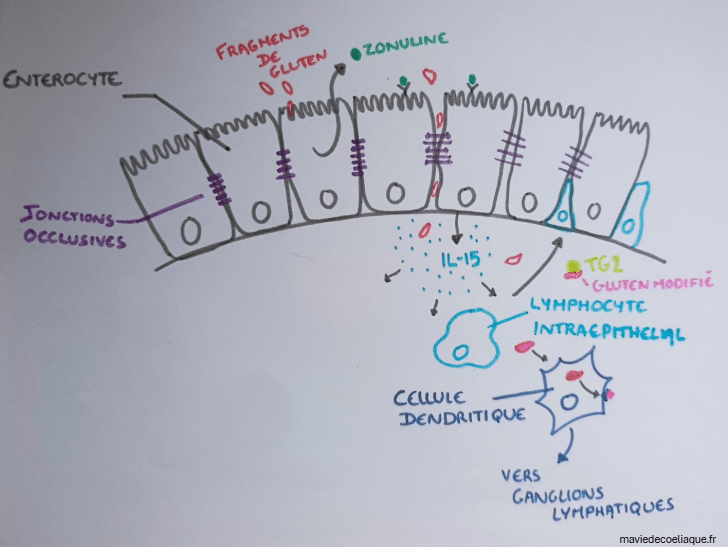
Les altérations de l’épithélium intestinal et l’inflammation locale s’accompagnent de la mise en jeu d’une enzyme déjà présente dans l’organisme : la transglutaminase tissulaire (TG2).
La TG2 est une enzyme normalement impliquée dans des processus physiologiques, notamment au niveau des tissus. Dans un contexte inflammatoire, son activité et son accessibilité peuvent être modifiées. Elle entre alors en interaction avec certains fragments de gluten présents dans la muqueuse intestinale.
Cette interaction conduit à une modification des peptides de gluten, en particulier de la gliadine. Ces peptides modifiés sont alors plus facilement reconnus par le système immunitaire.
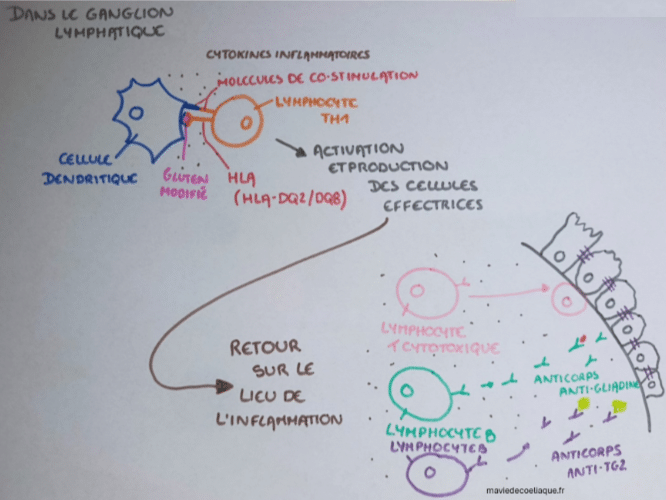
Dans la muqueuse intestinale, des cellules dendritiques sont présentes. Leur rôle est de capter des antigènes et de les présenter au système immunitaire adaptatif. Elles peuvent ainsi capturer ces fragments de gluten modifiés et migrer vers les ganglions lymphatiques.
Cette étape constitue un point clé des mécanismes moléculaires de la maladie cœliaque, car elle permet le passage d’une réponse immunitaire locale à l’activation d’une réponse adaptative spécifique.
Prédisposition génétique et activation des lymphocytes T
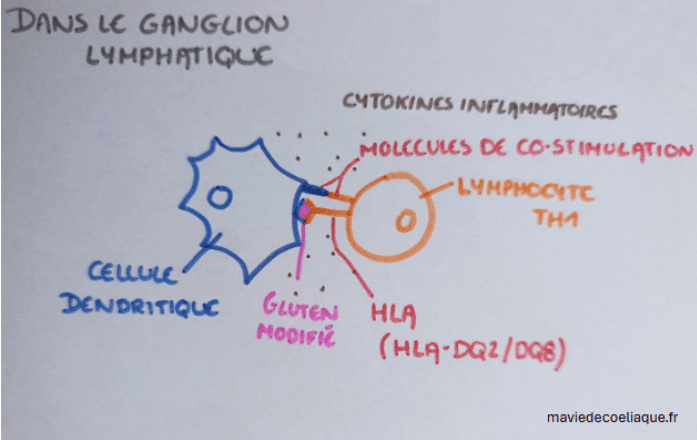
Les fragments de gluten modifiés par la transglutaminase tissulaire, une fois capturés par les cellules dendritiques, sont présentés au système immunitaire adaptatif. Cette présentation repose sur des molécules particulières, appelées molécules HLA, qui jouent un rôle central dans la reconnaissance des antigènes.
Dans la maladie cœliaque, cette étape implique principalement les molécules HLA-DQ2 et HLA-DQ8. Ces molécules ne correspondent pas à un gène unique, mais à des associations particulières d’allèles de gènes HLA, qui déterminent la forme des molécules HLA exprimées à la surface des cellules présentatrices d’antigènes. On les appelle : gènes de prédisposition en langage vulgarisé.
La présence de ces gènes facilite la présentation des fragments de gluten modifiés aux lymphocytes T CD4+, et en particulier à des lymphocytes de type TH1. Cette reconnaissance entraîne l’activation de ces lymphocytes, ainsi que leur multiplication.
Il est cependant important de souligner que la présence de ces allèles HLA n’est pas suffisante pour entraîner le développement d’une maladie cœliaque. De nombreuses personnes portent HLA-DQ2 ou HLA-DQ8 sans jamais développer la maladie. Cela montre que la maladie cœliaque résulte d’une interaction complexe entre prédisposition génétique, exposition au gluten et mécanismes de régulation du système immunitaire.
Cette étape constitue un tournant majeur dans les mécanismes moléculaires de la maladie cœliaque, car elle marque l’entrée dans une réponse immunitaire adaptative spécifique, qui va s’amplifier et s’auto-entretenir dans le temps.
Amplification de la réponse immunitaire et lésions de la muqueuse intestinale
L’activation des lymphocytes T de type TH1 dans les ganglions lymphatiques entraîne la mise en place d’une réponse immunitaire adaptative spécifique. Ces lymphocytes activés produisent différentes cytokines pro-inflammatoires, qui vont diffuser et agir à distance.
Sous l’effet de ces signaux, d’autres cellules du système immunitaire sont recrutées et activées, notamment des lymphocytes T cytotoxiques. Ces cellules migrent vers la muqueuse intestinale, où elles participent à l’altération progressive des entérocytes.
Cette action ne correspond pas à une destruction brutale, mais à un processus inflammatoire chronique, qui s’installe dans le temps. L’épithélium intestinal est progressivement fragilisé, ce qui conduit à une diminution de la surface d’échange de la muqueuse intestinale.
Cette diminution est liée à l’atrophie des villosités intestinales, structures normalement impliquées dans l’absorption des nutriments. C’est cette altération de la muqueuse intestinale qui explique en grande partie les conséquences fonctionnelles de la maladie cœliaque.
L’ensemble de ces phénomènes illustre la manière dont les mécanismes moléculaires de la maladie cœliaque aboutissent à des lésions intestinales, non pas par un mécanisme unique, mais par une réponse immunitaire inappropriée, prolongée et auto-entretenue en présence de gluten.
L’étude des mécanismes moléculaires de la maladie cœliaque permet de mieux comprendre comment une réponse immunitaire normalement protectrice peut devenir inadaptée dans un contexte particulier. La maladie cœliaque ne résulte pas d’un dysfonctionnement unique, mais d’une succession d’événements impliquant la barrière intestinale, l’immunité innée, l’immunité adaptative et un terrain génétique prédisposant.
Ces mécanismes reposent sur des interactions fines et très contrôlées entre différentes cellules du système immunitaire, dans des lieux distincts comme la muqueuse intestinale et les ganglions lymphatiques. La présence de certains allèles HLA facilite la reconnaissance de fragments de gluten, sans pour autant suffire à déclencher la maladie à elle seule.
Comprendre cette complexité est essentiel pour éviter les raccourcis, les généralisations abusives et la désinformation. Cela permet aussi de rappeler que la maladie cœliaque est une pathologie bien définie, avec des mécanismes spécifiques, qui ne peut être assimilée à une allergie, une intolérance ou à une réaction non spécifique au gluten. C’est une maladie auto-immune.
Les recherches se poursuivent activement pour affiner ces modèles, explorer d’autres voies impliquées et mieux comprendre pourquoi certaines personnes développent la maladie alors que d’autres, pourtant génétiquement prédisposées, ne la développeront jamais.
Sources scientifiques et mises à jour +
Date de publication initiale : 29 juillet 2016
Dernière mise à jour : 22 janvier 2026
Sources scientifiques principales :
- Green P.H.R., Jabri B. Celiac disease, New England Journal of Medicine, 2003
- Fasano A., Catassi C. Celiac disease, Gastroenterology, 2012
- Ludvigsson J.F. et al. The Oslo definitions for coeliac disease, Gut, 2013
- Sollid L.M., Jabri B. Triggers and drivers of autoimmunity: lessons from coeliac disease, Nature Reviews Immunology, 2013
- Abadie V., Jabri B. IL-15: a central regulator of celiac disease immunopathology, Immunological Reviews, 2014
- Koning F. Pathophysiology of celiac disease, Journal of Pediatric Gastroenterology and Nutrition, 2015
- Tye-Din J.A., Galipeau H.J., Agardh D. Celiac disease: a review of current concepts, New England Journal of Medicine, 2018
- Abadie V., Discepolo V., Jabri B. Immunogenetic bases of coeliac disease, Gut, 2012
- Haute Autorité de Santé, Maladie cœliaque : diagnostic et prise en charge, 2024
Veille scientifique Cet article repose sur l’état actuel des connaissances scientifiques concernant la maladie cœliaque. Les données scientifiques évoluant, son contenu est relu et mis à jour afin de rester conforme aux publications de référence. Je fais une veille tous les mois et modifie les éléments qui ne sont plus à jour systématiquement lorsqu’ils sont détectés.
A propos de l’autrice : Professeure de sciences de la vie et de la Terre et malade coeliaque, je suis formée à la biologie et à l’analyse critique des données scientifiques. Je propose sur ce site un travail de vulgarisation scientifique autour de la maladie cœliaque et du régime sans gluten, fondé sur des sources scientifiques et institutionnelles. Les contenus ont une visée informative et pédagogique car je suis convaincue que l’on vit mieux sa maladie lorsqu’on la comprend. Aucun conseil médical ne sera délivré sur ce site ou en commentaire. Une prise en charge par un(e) médecin est essentielle si vous avez des doutes.
Obtenir de l’aide pour comprendre la maladie :
Vous vous sentez un peu perdu(e) ?
J’ai créé des mini-cours d’introduction pour aider à mieux comprendre la maladie cœliaque et ce que recouvre l’alimentation sans gluten.
Ces mini-cours permettent de comprendre les bases, de poser des repères et d’avancer plus sereinement dans cette période de découverte, qui n’est pas toujours facile à vivre.
Ils ont été conçus pour répondre aux questions que l’on se pose lorsque l’on est concerné(e) par la maladie ou engagé(e) dans un parcours de diagnostic. Leur objectif n’est pas d’encourager un changement alimentaire en dehors d’un cadre médical, mais au contraire d’aider à y voir plus clair et à s’orienter vers les professionnels de santé à même de vous accompagner.
Vous pouvez me poser vos questions à tout moment.
Ces mini-cours sont entièrement gratuits, car je mesure l’importance de pouvoir être guidé(e) et accompagné(e) dans cette période souvent déstabilisante. Je l’ai moi-même vécue, et j’aurais aimé pouvoir bénéficier de ce type de repères.
Pour plus d’informations:
🌱 Zoom sur la maladie coeliaque
🌱 Zoom sur le système immunitaire de l’Homme
Afin de préserver un cadre bienveillant et respectueux de la confidentialité, les commentaires sont désactivés sur les articles de vulgarisation scientifique. Ces contenus ont pour objectif d’informer et de mieux comprendre, et ne se substituent pas à un avis médical.

